Thuốc ung thư của Nga không phải phát minh mới
Trước các “tin đồn” về thuốc ung thư của Nga là phát minh mới, trao đổi với VietTimes sáng 12/11, ông Nguyễn Văn Lợi, Trưởng phòng Đăng ký thuốc (Cục Quản lý Dược Bộ Y tế) nhấn mạnh: Thuốc Pembroria® (INN: pembrolizumab) của Nga không phải là thuốc mới, mà là sản phẩm tương tự sinh học của thuốc gốc pembrolizumab của Hãng dược MSD – một công ty dược phẩm đa quốc gia của Mỹ – đã được cấp phép lưu hành từ năm 2017.
“Đây là một loại kháng thể đơn dòng điều trị ung thư, không mang tính phát minh hay mới gì cả. Pembroria chỉ là sinh phẩm tương tự của sinh phẩm tham chiếu gốc đã được phép sử dụng rộng rãi cho bệnh nhân ung thư lâu nay” - ông Lợi thông tin.
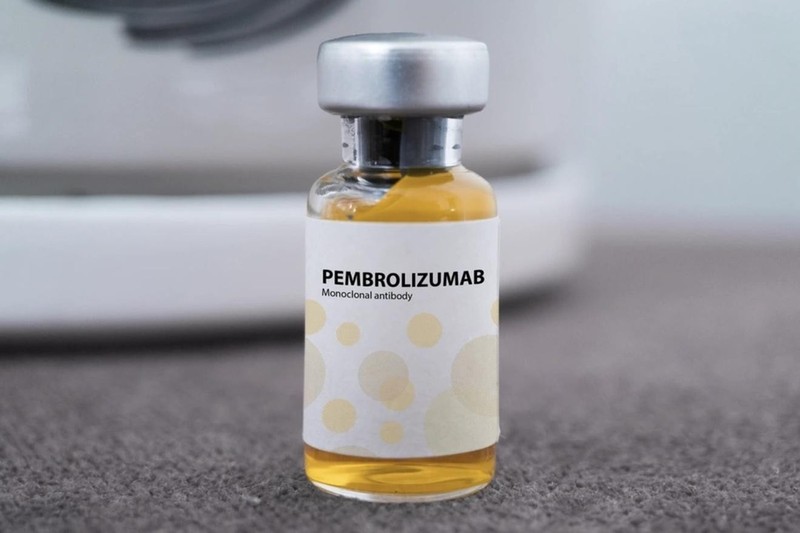
Pembroria là thuốc sinh học tương tự (biosimilar) do Công ty JSC “BIOCAD” (Nga) sản xuất, bào chế dưới dạng dung dịch đậm đặc pha dung dịch tiêm truyền, được Bộ Y tế cấp số đăng ký lưu hành tại Việt Nam theo Quyết định số 628/QĐ-QLD ngày 31/10/2025 với yêu cầu “phải định kỳ 3 tháng một lần kể từ ngày cấp giấy đăng ký lưu hành thực hiện cập nhật tiến độ triển khai nghiên cứu lâm sàng theo dõi tính sinh miễn dịch pha III”.
Thông tin cho biết thuốc ung thư của Nga vẫn đang trong thời gian “nghiên cứu lâm sàng theo dõi tính sinh miễn dịch pha III” được dư luận đặc biệt quan tâm.
Giải thích về điều này, bà Lương Thu Vinh, Phó Trưởng phòng Đăng kí thuốc Cục Quản lý Dược, cho biết thuốc này đã hoàn thành các nghiên cứu lâm sàng cần thiết. Việc doanh nghiệp tiếp tục đánh giá ‘tính sinh miễn dịch pha III là nghiên cứu bổ sung sau cấp phép, để cập nhật dữ liệu an toàn và đáp ứng yêu cầu quản lý nguy cơ theo quy định của cơ quan quản lý.
Theo bà Vinh, quy định của Cơ quan Dược phẩm châu Âu (EMA) cho phép sinh phẩm tương tự được cấp phép sau khi hoàn thành nghiên cứu lâm sàng chứng minh tính tương đồng với thuốc gốc. Việc theo dõi “tính sinh miễn dịch” được thực hiện trong giai đoạn sau cấp phép và không đồng nghĩa với “đang thử nghiệm lâm sàng”.
“Ở Việt Nam, quy trình còn chặt chẽ hơn cả EMA. Chúng tôi yêu cầu doanh nghiệp định kỳ 3 tháng một lần phải báo cáo tiến độ nghiên cứu, nộp dữ liệu cập nhật cho Cục Quản lý Dược xem xét. Đây là cách làm thận trọng, bảo đảm an toàn cho người bệnh” – bà Vinh chia sẻ.
Chưa thể đánh giá hiệu quả điều trị
Chuyên gia hàng đầu về ung thư, PGS.TS Phạm Cẩm Phương, Giám đốc Trung tâm Y học hạt nhân và ung bướu Bệnh viện Bạch Mai, cũng lưu ý đây không phải là thuốc mới, mà là dạng thuốc tương tự sinh học. Nhưng thêm thuốc này được cấp phép thì bệnh nhân sẽ có cơ hội được dùng thuốc Pembrolizumab (thuốc điều trị miễn dịch) với chi phí rẻ hơn.
Đánh giá về chất lượng thuốc ung thư của Nga, một số chuyên gia về dược nhấn mạnh rằng chưa thể biết được hiệu quả điều trị của thuốc ra sao với bệnh nhân ở Việt Nam vì hiện thuốc chưa có ở nước ta, mà phải năm 2026 mới có. Đặc biệt, chất lượng thuốc phụ thuộc rất nhiều vào quá trình nghiên cứu có làm bài bản theo quy định, xu hướng chung của thế giới hay không.

Thuốc ung thư của Nga mới được cấp đăng ký: Việt Nam đã cấp phép cho nhiều loại tương tự từ lâu

Sau 3 tháng thử nghiệm thuốc chữa ung thư tại Việt Nam: Các bệnh nhân đều có tín hiệu tốt