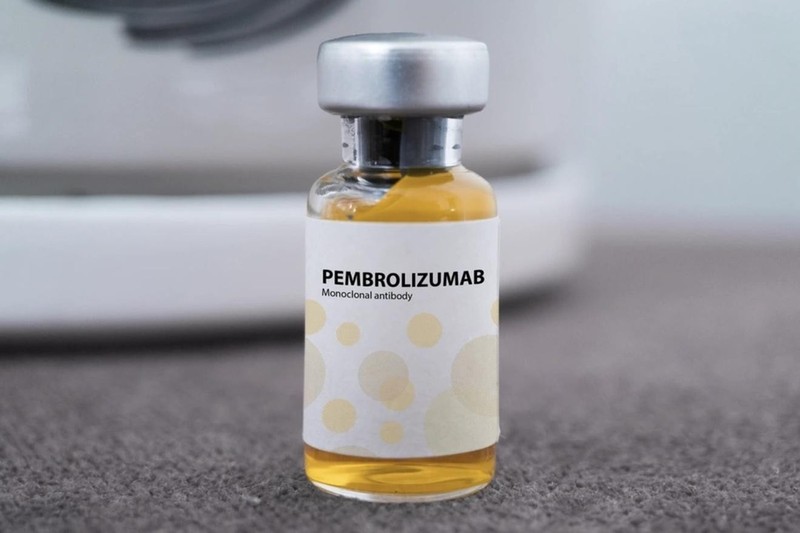
Theo tìm hiểu của VietTimes, ngày 31/10/2025, ông Vũ Tuấn Cường, Cục trưởng Cục Quản lý Dược Bộ Y tế, đã ký Quyết định số 628/QĐ-QLD về việc cấp giấy đăng ký lưu hành tại Việt Nam cho 14 vắc xin, sinh phẩm, trong đó có thuốc sinh phẩm Pembroria - thuốc chống ung thư - bản sinh học tương tự do Công ty Nga JSC “BIOCAD” sản xuất, là Pembroria® (INN: pembrolizumab).
Quyết định cấp đăng ký yêu cầu cơ sở sản xuất và cơ sở đăng ký thuốc có trách nhiệm sản xuất, cung cấp thuốc vào Việt Nam theo đúng các hồ sơ, tài liệu đã đăng ký với Bộ Y tế và phải in hoặc dán số đăng ký được Bộ Y tế Việt Nam cấp lên nhãn thuốc; Chấp hành đầy đủ pháp luật của Việt Nam và các quy định của Bộ Y tế về sản xuất, nhập khẩu thuốc và lưu hành thuốc tại Việt Nam, nếu có bất cứ thay đổi gì trong quá trình lưu hành thuốc ở nước sở tại và ở Việt Nam thì phải báo cáo ngay cho Cục Quản lý Dược - Bộ Y tế Việt Nam.
Cục Quản lý Dược cũng yêu cầu cơ sở đăng ký thuốc phải báo cáo Bộ Y tế việc duy trì đáp ứng thực hành tốt sản xuất của cơ sở sản xuất thuốc, nguyên liệu làm thuốc. Trường hợp cơ sở sản xuất bị thu hồi giấy phép sản xuất hoặc không đáp ứng thực hành tốt sản xuất thuốc, nguyên liệu làm thuốc ở nước sở tại, cơ sở phải thực hiện việc báo cáo trong thời hạn 15 ngày kể từ ngày có thông báo của cơ quan quản lý có thẩm quyền nước sở tại.
Các cơ sở sản xuất và đăng ký thuốc phối hợp với các cơ sở điều trị, cơ sở y tế dự phòng để thực hiện theo đúng các quy định hiện hành về thuốc kê đơn, theo dõi an toàn, hiệu quả, tác dụng không mong muốn của thuốc trên người Việt Nam và tổng hợp, báo cáo theo quy định.
Trước thông tin trên mạng xã hội giới thiệu về việc loại thuốc ung thư của Nga vừa được cấp phép có nhiều tính năng vượt trội hơn các thuốc đã có ở Việt Nam, nói với VietTimes, ông Tạ Mạnh Hùng, Phó cục trưởng Cục Quản lý Dược, và được biết trên thực tế, thuốc sinh phẩm tham chiếu đã được cấp giấy đăng ký lưu hành từ nhiều năm nay. Loại thuốc Pembroria này của Nga là sinh phẩm tương tự, mới được cấp giấy đăng ký lưu hành. Thực tế, nhiều loại thuốc có tác dụng và chỉ định như thuốc Pembroria được cấp giấy đăng ký lưu hành ở Việt Nam từ lâu.
Thuốc Pembroria có hoạt chất chính là Pembrolizumab, hàm lượng 100mg/4ml) do Công ty Limited Liability "PK-137" (Nga) sản xuất, một cơ sở ở Các Tiểu Vương quốc Ả Rập Thống nhất đăng ký và cơ sở này có Văn phòng đại diện tại TPHCM.
Đây không phải là thuốc mới, mà là sản phẩm tương tự với sinh phẩm tham chiếu gốc của Hãng dược MSD (công ty dược phẩm đa quốc gia của Mỹ) đã được cấp phép lưu hành từ năm 2017.