Theo Cục Quản lý Dược (Bộ Y tế), đây là các cơ sở sản xuất có thuốc vi phạm chất lượng của Bộ Y tế, buộc phải lấy mẫu kiểm tra chất lượng 100% lô thuốc nhập khẩu sau khi cơ quan chức năng thực hiện công tác giám sát chất lượng thuốc lưu hành.
Ngoài ra, trên cơ sở kết quả kiểm tra, Cục Quản lý Dược đã rút tên của 6 công ty ra khỏi danh sách các công ty nước ngoài có thuốc vi phạm chất lượng do đã thực hiện lấy mẫu kiểm tra chất lượng 100% lô nhập khẩu và không có lô thuốc nào vi phạm chất lượng theo quy định.
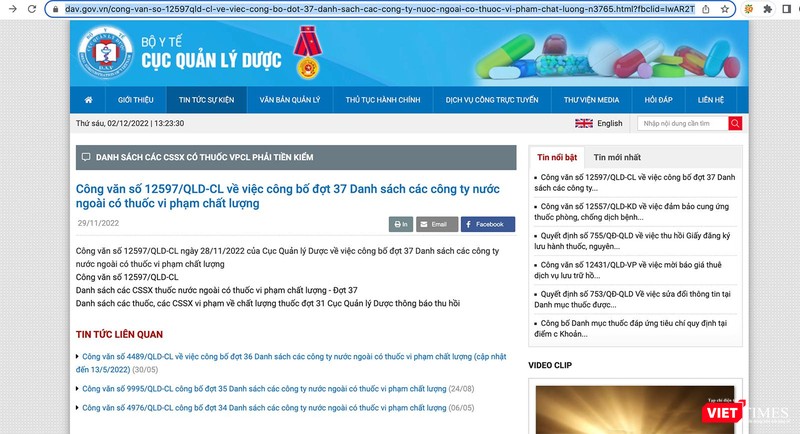
Danh sách cập nhật các công ty nước ngoài có thuốc vi phạm chất lượng được đăng tải trên trang thông tin điện tử của Cục Quản lý Dược tại địa chỉ: https://dav.gov.vn/cong-van-so-12597qld-cl-ve-viec-cong-bo-dot-37-danh-sach-cac-cong-ty-nuoc-ngoai-co-thuoc-vi-pham-chat-luong-n3765.html?fbclid=IwAR2TZXTaJ8VSfcGQWS1su8TB6-bGGmKkLtrkGmullnb8I3ZA86OC5OZMFPk
Bên cạnh đó, Cục Quản lý Dược thông báo thu hồi các sản phẩm thuốc mang tên Neometin (VN-17936-14), do Công ty Genome Pharmaceutical (Pvt) Ltd (Pakistan) sản xuất và Công ty TNHH Nacopharm Miền Bắc (Số 10, ngõ 95, đường Trung Tựu, phường Tây Tựu, quận Bắc Từ Liêm, TP Hà Nội) nhập khẩu; sản phẩm dung dịch uống Batiwell (VD-31011-18), do Công ty CP 23 tháng 9 sản xuất. Các sản phẩm thu hồi do vi phạm các điều kiện về chất lượng.
Cục Quản lý Dược đề nghị Sở Y tế các địa phương chỉ đạo các đơn vị thanh tra, quản lý dược và kiểm nghiệm thuốc thuộc Sở tiến hành kiểm tra, giám sát việc chấp hành các quy định về kiểm tra chất lượng thuốc nhập khẩu lưu hành trên địa bàn quản lý và xử lý các tổ chức/cá nhân vi phạm theo quy định hiện hành.

Hàng loạt mỹ phẩm bị Cục Quản lý Dược đình chỉ lưu hành do kém chất lượng

Cục Quản lý Dược cảnh báo dung dịch rửa tay khô Aerius chai 500ml có dấu hiệu là hàng giả