Sau khi Tổng thống Mỹ Donald Trump tuyên bố áp thuế 46% với Việt Nam, mạng xã hội bàn tán về nội dung trong Báo cáo những rào cản thương mại năm 2024, việc phía Mỹ “phàn nàn” về quy trình thủ tục cấp phép thuốc, nhất là thuốc mới hoặc nhập khẩu cho thử nghiệm lâm sàng.
Để làm rõ câu chuyện này trong bối cảnh “nhạy cảm” hiện nay, VietTimes có cuộc trao đổi với ông Lê Việt Dũng - Phó Cục trưởng Cục quản lý Dược (Bộ Y tế).

-Trong lĩnh vực dược phẩm có phải vẫn tồn tại hạn chế với các doanh nghiệp FDI, trong khi Luật Dược sửa đổi 2024 được đánh giá “mở tung” cánh cửa về thủ tục hành chính trong cấp phép thuốc, gia hạn thuốc, thưa ông?
- Thuốc là hàng hóa đặc biệt vì liên quan trực tiếp đến sức khỏe con người, nên quy trình cấp phép phải bảo đảm chặt chẽ để lựa chọn được thuốc có chất lượng, an toàn và hiệu quả. Nhưng, để tăng cường khả năng được tiếp cận thuốc của người dân, Bộ Y tế đã cắt giảm và cải cách, đơn giản hóa các thủ tục hành chính, tạo thuận lợi cho các doanh nghiệp khi đăng ký lưu hành thuốc tại Việt Nam.
Luật số 44 sửa đổi, bổ sung một số điều của Luật Dược năm 2016 (Luật dược sửa đổi 2024), đã đơn giản hóa hồ sơ theo hướng phân loại các trường hợp hồ sơ đăng ký thuốc có yêu cầu hoặc không yêu cầu thẩm định, tư vấn của Hội đồng. Đặc biệt, thời gian giải quyết hồ sơ thay đổi, bổ sung được giảm từ 3 tháng xuống 20 ngày, nhưng vẫn đảm bảo không ảnh hưởng đến chất lượng, an toàn, hiệu quả của thuốc.
Ngoài ra, Bộ Y tế cho phép cơ sở được tiếp tục sử dụng Giấy đăng ký lưu hành sau khi hết hiệu lực và đã nộp hồ sơ gia hạn đến khi được gia hạn hoặc có văn bản của Bộ Y tế, nhằm không gián đoạn nguồn cung ứng thuốc cho nhu cầu khám, chữa bệnh.
Bên cạnh đó, Bộ Y tế đã có quy định ưu tiên về trình tự, thủ tục, thời gian cấp Giấy đăng ký lưu hành thuốc, nguyên liệu làm thuốc đối với một số nhóm sản phẩm cụ thể như thuốc mới; thuốc biệt dược gốc; thuốc hiếm; vắc xin; thuốc công nghệ cao; thuốc đã được thử lâm sàng tại Việt Nam, hay vắc xin đã được WHO tiền thẩm định.
Những quy định mới này được đánh giá là nỗ lực của Bộ Y tế nhằm cắt giảm tối đa các thủ tục hành chính trong đăng ký lưu hành thuốc tại Việt Nam.

-Có ý kiến cho rằng Việt Nam cần tự động cấp đăng ký lưu hành cho các thuốc xuất xứ từ Mỹ, không cần thẩm định gì thêm, vì quy trình xét duyệt cấp phép thuốc ở Mỹ khắt khe nhất thế giới. Quan điểm của ông về điều này?
- Với Luật Dược sửa đổi 2024, Bộ Y tế đã có nhiều ưu tiên về tiêu chí, trình tự, thủ tục, thời gian cấp phép nhập khẩu đối với thuốc mới; thuốc hiếm; vắc xin đã được WHO tiền thẩm định; thuốc công nghệ cao. Đây cũng là những mặt hàng thế mạnh của các nhà sản xuất dược phẩm từ Mỹ.
Bộ Y tế cũng ban hành quy định về việc áp dụng hình thức tham chiếu kết quả thẩm định hồ sơ đăng ký thuốc của cơ quan quản lý dược chặt chẽ (SRA), hoặc cơ quan quản lý về dược được Bộ Y tế công nhận, trong đó có cơ quan quản lý dược và thực phẩm Hoa Kỳ (US-FDA). Quy trình giải quyết hồ sơ sẽ được rút ngắn chỉ còn 9 tháng, giúp tiết kiệm nguồn nhân lực, tăng cường tiếp cận thuốc.
Đối với thuốc mới (trừ vắc xin) sản xuất trong nước có chỉ định sử dụng phòng, điều trị bệnh truyền nhiễm thuộc nhóm A đã được công bố dịch, và có cùng hoạt chất, dạng bào chế, đường dùng, chỉ định với thuốc đã được cấp phép lưu hành bởi một trong các cơ quan quản lý dược chặt chẽ như US-FDA sẽ được miễn nộp hồ sơ lâm sàng trong hồ sơ đề nghị cấp giấy đăng ký lưu hành thuốc. Thời hạn cấp, gia hạn hoặc thay đổi, bổ sung trong trường hợp đặc thù như vậy là không quá 15 ngày kể từ ngày nhận đủ hồ sơ.
-Thủ tục cấp phép cho nhập khẩu thuốc dùng cho mục đích thử lâm sàng có được cải tiến không, thưa ông?
- Luật Dược sửa đổi 2024 quy định, thuốc chưa có giấy đăng ký lưu hành thuốc tại Việt Nam sử dụng cho thử nghiệm thuốc trên lâm sàng được nhập khẩu mà không cần cấp phép nhập khẩu với số lượng, chủng loại theo đúng thông tin được công bố trên Cổng thông tin điện tử của Bộ Y tế, trên cơ sở thuyết minh đề cương nghiên cứu thử thuốc trên lâm sàng đã được Bộ Y tế phê duyệt, trừ thuốc phải kiểm soát đặc biệt.
Đây là cải cách hành chính rất lớn, tạo điều kiện cho doanh nghiệp được nhập khẩu thuốc mà không phải làm thủ tục đề nghị cấp phép nhập khẩu thuốc sử dụng cho thử nghiệm thuốc trên lâm sàng, mà không phải là thuốc phải kiểm soát đặc biệt.
Ngoài ra, với thuốc phải kiểm soát đặc biệt, dự thảo Nghị định hướng dẫn Luật Dược thay thế Nghị định số 54/2017/NĐ-CP đang xây dựng quy định theo hướng phân cấp việc cấp phép nhập khẩu thuốc phải kiểm soát đặc biệt sử dụng cho thử nghiệm thuốc trên lâm sàng cho các Sở Y tế giải quyết, nhằm góp phần đẩy nhanh tiến độ giải quyết thủ tục hành chính này.
-Để Luật Dược sửa đổi đi vào cuộc sống từ 1/7/2025, Bộ Y tế tiếp tục cải cách hành chính mạnh mẽ trong việc cấp đăng ký lưu hành thuốc. Ông có thể chia sẻ về vấn đề này?
- Bộ Y tế đang xây dựng Thông tư thay thế Thông tư số 08/2022/TT-BYT quy định việc đăng ký lưu hành thuốc, nguyên liệu làm thuốc, dự kiến sẽ hoàn thành trong 5/2025. Trong đó, Thông tư mới không yêu cầu phải nộp thêm CPP/giấy tờ pháp lý của cơ quan quản lý SRA cấp phép trong trường hợp thuốc mới đã có CPP của nước sản xuất cấp phép lưu hành.
Quy định này tại dự thảo Thông tư đã nhận được nhiều phản hồi tích cực từ cộng đồng doanh nghiệp dược, dự kiến sẽ tháo gỡ nhiều khó khăn, vướng mắc khi đăng ký lưu hành các thuốc mới tại Việt Nam.

-Những cải cách thủ tục hành chính cùng với việc chuyển đổi số thời gian qua đã mang lại kết quả ra sao, thưa ông?
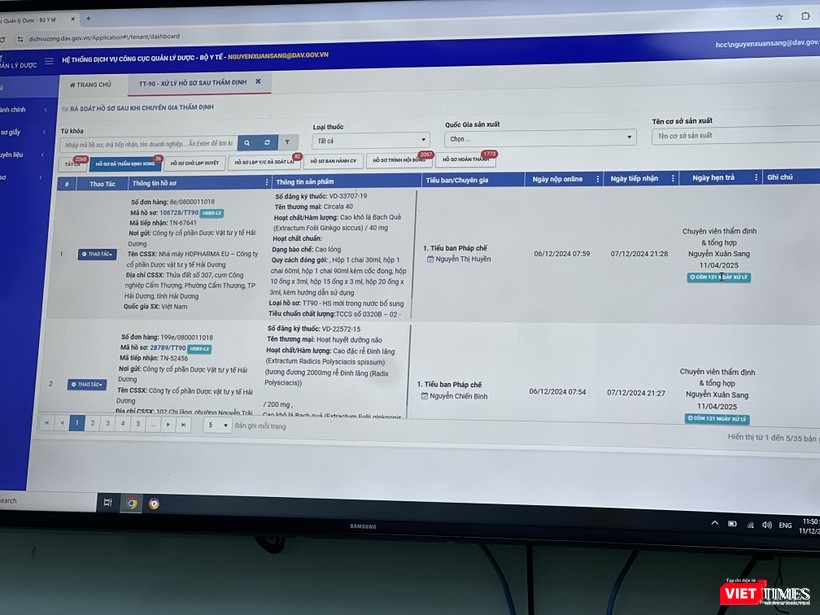
- Với hàng loạt cải cách thủ tục hành chính cùng với ứng dụng CNTT, việc thẩm định và xử lý hồ sơ đăng ký thuốc hoàn toàn trên môi trường điện tử từ tháng 7/2023, nên thời gian giải quyết hồ sơ đăng ký thuốc của Cục Quản lý Dược đã rút ngắn đáng kể, bảo đảm công khai, minh bạch, người dân theo dõi được toàn bộ quá trình giải quyết.
Nhờ đó, số lượng hồ sơ giải quyết tăng cao và riêng năm 2024 đã cấp hơn 13.504 thuốc (bằng số lượng của 5 năm trước cộng lại). Chỉ 3 tháng đầu năm 2025, Cục Quản lý Dược đã cấp, gia hạn cho 1.794 thuốc.
Đây là kết quả của việc cải cách thủ tục hành chính, rút ngắn thời gian cấp phép, tạo thuận lợi cho doanh nghiệp, chuyên gia/đơn vị thẩm định và công tác quản lý của Cục Quản lý Dược.
-Cảm ơn ông đã trao đổi!

Chuyển đổi số tạo đột phá trong quản lý dược và an toàn thực phẩm

Chuyển đổi số trong đăng ký thuốc: Tốc độ cấp 11 tháng bằng 5 năm cộng lại