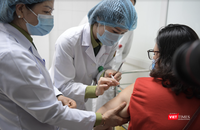
Hội đồng đạo đức mới thông qua báo cáo giữa kỳ
* Kết luận chính thức của Hội đồng Đạo đức trong nghiên cứu Y Sinh học Quốc gia (Hội đồng Đạo đức) khi họp xem xét kết quả giữa kỳ thử nghiệm lâm sàng giai đoạn 3 vaccine Nanocovax vào ngày 18/9 cho rằng vaccine Nanocovax đạt yêu cầu về tính an toàn trong ngắn hạn dựa trên dữ liệu báo cáo kết quả giữa kỳ thử nghiệm lâm sàng giai đoạn 3 tính đến thời điểm hiện tại (kết quả theo dõi 7 ngày sau tiêm mũi 1 của 11.430 người tình nguyện; kết quả theo dõi 7 ngày sau tiêm mũi 2 của 5.785 người tình nguyện). Đáng chú ý, về hiệu quả bảo vệ (kết quả quan trọng nhất về chất lượng của vaccine), Hội đồng khẳng định đến thời điểm hiện tại, vẫn chưa có dữ liệu để đánh giá trực tiếp hiệu lực bảo vệ của vaccine Nanocovax dựa trên số trường hợp mắc COVID-19 trong nghiên cứu. Vì thế, nhóm nghiên cứu cần tiếp tục thực hiện đánh giá về hiệu lực bảo vệ theo đề cương được phê duyệt. Xin ông phát biểu quan điểm về chuyện này?
TS Bùi Lê Minh: - Tôi hoàn toàn đồng ý với ý kiến của Hội đồng Đạo đức. Yếu tố quan trọng nhất chúng ta cần quan tâm tới là hiệu quả thực tế của vaccine, đặc biệt là khả năng làm giảm tỷ lệ bệnh nặng và tử vong.
Bài học gần đây nhất cho chúng ta là trường hợp của một vaccine mRNA là CureVac (Đức), mặc dù ở pha I đã đánh giá được tính an toàn ngắn hạn và xác định được tỷ lệ chuyển đổi huyết thanh 100% ở ngày thứ 43 sau mũi thứ hai và 91% tình nguyện viên xuất hiện kháng thể trung hòa với hiệu giá gấp 4 lần trở lên so với trước khi tiêm vaccine, thậm chí chứng minh được cơ chế miễn dịch tế bào được kích hoạt, nhưng đến pha IIb/III thì vaccine này chỉ đạt hiệu quả 47%, không đạt mức tối thiểu 50% để có thể xin cấp phép sử dụng khẩn cấp.
Ngoài ra, một số nghiên cứu cũng chỉ ra rằng hiệu giá kháng thể trung hòa không phải lúc nào cũng phản ánh khả năng bảo vệ thực tế. Vai trò của phản ứng miễn dịch tế bào rất quan trọng trong khả năng bảo vệ của vaccine, đặc biệt là giúp giảm ca nặng, tử vong, nhưng chúng ta có quá ít thông tin về cơ chế này với Nanocovax. Các kết quả chúng ta đang có không thể làm bằng chứng trực tiếp cho hiệu lực bảo vệ của vaccine.
*Phê duyệt khẩn cấp vaccine Nanocovax do Việt Nam sản xuất ở thời điểm này, theo ông đã là quyết định hợp lý hay chưa?
TS Bùi Lê Minh: - Tôi ủng hộ việc tinh giản các thủ tục và một số yêu cầu không quá quan trọng để vaccine được cấp phép sớm hơn quy trình thông thường ở Việt Nam và tôi nghĩ nhiều người Việt Nam cũng mong mỏi điều này để chúng ta sớm có một vaccine nội địa. Tuy nhiên các tiêu chí quan trọng nhất vẫn cần phải có bằng chứng trực tiếp để làm cơ sở cấp giấy phép.
Tất cả các vaccine xin cấp phép khẩn cấp trên thế giới, có lẽ trừ Sputnik V của Nga thì đều đã có dữ liệu về hiệu quả bảo vệ thực tế từ báo cáo pha 2 hoặc giữa kỳ pha 3 để làm cơ sở, nên Nanocovax cũng không nên là một ngoại lệ. Riêng với trường hợp của Sputnik V thì việc họ được cấp phép sớm ở Nga cũng là cấp phép có điều kiện, để công ty thực hiện các hoạt động thương mại, nhưng không được sử dụng rộng rãi cho tới 5 tháng sau thời điểm cấp phép có điều kiện và chỉ được phép dùng để tiêm cho một số nhỏ các đối tượng có nguy cơ cao trong giai đoạn này.
Điều này có nghĩa là việc cấp phép chỉ là thực hiện các thủ tục hành chính và vaccine vẫn phải hoàn thành thử nghiệm lâm sàng lớn trước thời điểm được chính thức sử dụng. Nếu doanh nghiệp tự tin vào chất lượng sản phẩm và muốn nhanh chóng thương mại hóa thì tôi nghĩ đây là cách hợp lý mà Bộ Y tế có thể xem xét cho việc cấp phép khẩn cấp Nanocovax.
 |
TS Bùi Lê Minh cho biết, vaccine mRNA là CureVac (Đức), mặc dù ở pha I đã đánh giá được tính an toàn ngắn hạn, nhưng đến pha IIb/III thì vaccine này chỉ đạt hiệu quả 47%, không đạt mức tối thiểu 50% để có thể xin cấp phép sử dụng khẩn cấp |
*Về tính sinh miễn dịch, Hội đồng kết luận vaccine Nanocovax có tính sinh miễn dịch dựa trên dữ liệu báo cáo kết quả giữa kỳ thử nghiệm lâm sàng giai đoạn 3 tính đến thời điểm hiện tại (kết quả xét nghiệm nồng độ kháng thể Anti-S IgG trên 924 mẫu ngày 42 sau tiêm mũi 1; kết quả xét nghiệm hoạt tính trung hòa virus trên 761 mẫu ngày 42 sau tiêm mũi 1; kết quả trung bình nhân hiệu giá kháng thể trung hòa PRNT ngày 42 sau tiêm mũi 1 trên 107 mẫu chủng Vũ Hán; 41 mẫu chủng Delta; 39 mẫu chủng Alpha). Được biết ở ngày 42 hàm lượng Anti-S IgG đo được kết quả rất khác nhau ở những tình nguyện viên khác nhau, có người chỉ 0,25 đơn vị có người 600 đơn vị. Xin ôngcho biết sự biến thiên lớn như vậy nói lên điều gì?
TS Bùi Lê Minh: Một khảo sát về khả năng sinh kháng thể kháng protein S với gần 46.000 người tham gia ở Anh cho thấy là ở các thời điểm sau khi tiêm vaccine Pfizer/BioNTech hay AstraZeneca thì tỷ lệ người tham gia đạt chuyển đổi huyết thanh luôn dao động trong khoảng 80-100%, nghĩa là vào một thời điểm bất kỳ sau khi tiêm sẽ luôn có ghi nhận được những trường hợp không phát hiện ra kháng thể Anti-S IgG. Trong nghiên cứu này thì hàm lượng IgG được đo bằng đơn vị ng/ml và cũng có sai khác rất lớn giữa một số trường hợp được xác định là âm tính (< 2 ng/ml) và dương tính với trên 500 ng/ml IgG.
Ở đây khó có thể đánh giá toàn diện khi chúng ta chỉ biết được mức hàm lượng thấp nhất và cao nhất ghi nhận được và khoảng lệch như thế này cũng không có gì là bất thường. Không phải vaccine sẽ kích thích sinh kháng thể anti-S IgG ở tất cả mọi người mà còn phụ thuộc vào độ tuổi, trạng thái bệnh lý và những đặc trưng của hệ miễn dịch ở mỗi cá thể chúng ta còn chưa nắm hết được. Khoảng thời gian 42 ngày sau khi tiêm mũi 2 chỉ là khoảng thời gian ước đoán sẽ đủ để hình thành kháng thể đặc hiệu với SARS-CoV-2 ở phần lớn mọi người, nhưng sẽ có người đạt chuyển đổi huyết thanh trước thời điểm này, sau thời điểm này và có những người luôn luôn âm tính với anti-S IgG. Chúng ta cần thêm các dữ liệu về đặc điểm nhóm tình nguyện viên được đo hàm lượng IgG cũng như thực hiện thêm xét nghiệm này ở các thời điểm khác như 60, 90 ngày để có cái nhìn chính xác hơn.
Ngoài ra, liên quan tới việc đo hiệu giá kháng thể trung hòa với các biến thể như Delta là rất quan trọng. Quay lại câu chuyện của CureVac tôi đã nhắc tới ở trên, nguyên nhân chính khiến họ thất bại ở pha IIb/III sau này được phát hiện ra là trừ 1 người mang chủng Vũ Hán thì phần lớn tình nguyện viên mắc COVID-19 là mang chủng Lambda và các biến thể khác. Hiệu quả vaccine rất phụ thuộc vào biến thể đang phổ biến trong quần thể thí nghiệm và đây là bất lợi của các vaccine phát triển sau mà chúng ta buộc phải chấp nhận.
Mặc dù có những ý kiến cho rằng việc yêu cầu xác định hiệu lực của Nanocovax với các biến thể mới là không công bằng do các vaccine đã được cấp phép không phải làm điều này, nhưng bản thân các vaccine này cũng đang chịu áp lực phải “nâng cấp” phiên bản mới để đối phó với biến thể và các vaccine chưa được cấp phép đều phải chịu áp lực tương tự như với Nanocovax. Với biến thể Delta, tất cả các vaccine đang dựa vào protein S đều bị giảm sút hiệu lực nên đây là điểm tôi có phần lo ngại rằng Nanocovax cũng sẽ gặp phải trong kết quả lâm sàng.
 |
Tiêm vaccine COVID-19 cho người dân trong tâm dịch TP.HCM. Ảnh: Hoà Bình |
Sử dụng tá dược nhôm vì giá rẻ?
*Được biết, ban đầu Công ty Nanogen đã định theo đuổi công nghệ “hot” nhất bây giờ là mRNA, nhưng rồi họ quyết định sử dụng công nghệ protein tái tổ hợp – công nghệ mà họ vẫn dùng trong sản xuất thuốc sinh học để sản xuất vaccine Nanocovax. Nhiều người có phần “thất vọng” vì vaccine Nanocovax sử dụng chất bổ trợ “cũ” là nhôm. Theo ông, người Việt Nam có đủ lý do để tin tưởng vào vaccine Nanocovax?
TS Bùi Lê Minh: - Việc sử dụng tá dược nhôm đã phổ biến trên thế giới từ hơn 90 năm nay. Do các kháng nguyên tái tổ hợp phần lớn tạo đáp ứng miễn dịch kém nên người ta phải bổ sung tá dược có khả năng kích thích đáp ứng miễn dịch, giúp tăng hiệu lực, kéo dài thời gian bảo vệ của vaccine và giảm lượng kháng nguyên cần thiết trong một liều. Cho đến nay các tá dược nhôm đã được dùng trong hàng tỷ liều vaccine, khẳng định tính an toàn cao với mức độ gây phản ứng phụ thấp, và nó rất rẻ. Lượng muối nhôm dùng trong vaccine rất nhỏ so với ngưỡng độc hại của nhôm và cơ thể cũng dễ dàng đào thải nhôm, chỉ có đôi khi cơ thể phản ứng lại với nồng độ muối nhôm cao tại vị trí tiêm gây mẩn ngứa, tấy đỏ, nên nhìn chung tá dược này an toàn, không để lại hậu quả gì lâu dài. Người ta còn coi nhôm là tiêu chuẩn vàng cho tá dược trong vaccine và khi phát triển vaccine sử dụng một loại tá dược mới thì nên đối chiếu với vaccine sử dụng muối nhôm.
Cũng cần phải nói thêm là gọi chung thế nhưng chúng ta cũng cần phải phân biệt là tá dược nhôm dùng trong vaccine Nanocovax là nhôm hydroxit (aluminum hydroxide hay AH), là một trong hai loại tá dược nhôm dùng phổ biến trong vaccine bên cạnh muối nhôm phosphat (aluminum phosphate hay AP), chứ không phải các muối nhôm khác.
AH cũng đang được dùng trong 3 loại vaccine phòng COVID-19 đã được cấp phép sử dụng ở Việt Nam là Vero Cell (Sinopharm, Trung Quốc), Hayat-Vax (UAE) và Abdala (Cuba), còn các loại vaccine sử dụng adenovirus vector (AstraZeneca, Janssen, Sputnik V) và mRNA (Pfizer/BioNTech và Moderna) do bản thân đã tạo đáp ứng miễn dịch mạnh nên không cần sử dụng tá dược. Điều đó có thể thấy tá dược nhôm vẫn đang là lựa chọn phổ biến với các nhà phát triển vaccine truyền thống hơn như vaccine virus bất hoạt và vaccine tiểu phần virus.
Tuy nhiên, khi nhắc tới hiệu quả tăng cường đáp ứng miễn dịch thì tá dược nhôm không phải là lựa chọn tốt nhất. Tá dược này đã cho thấy là không có tác dụng tăng cường đáp ứng miễn dịch với vaccine cúm mùa và một số nghiên cứu so sánh cho thấy hiệu quả kích thích đáp ứng miễn dịch kém hơn một số loại tá dược mới. Theo như tôi được biết thì Nanogen cũng đã chia sẻ là họ đã thử nghiệm Nanocovax với nhiều loại tá dược và nhôm cho hiệu quả đáp ứng miễn dịch thấp, nhưng họ chọn vì giá thành thấp và an toàn.
Các phân tử cytokine có vai trò quan trọng trong phần lớn các hoạt động của hệ miễn dịch và chủ yếu được tạo ra từ các tế bào bạch cầu lympho T. Có hai nhóm lympho T phân biệt nhau ở sự có mặt của thụ thể trên bề mặt tế bào là CD4 và CD8, trong đó lympho T mang CD4 (còn gọi là tế bào T trợ giúp – T helper) được chia thành 2 loại là Th1 (T helper 1) và Th2 (T helper 2). Th1 và Th2 sinh ra 2 nhóm cytokine gọi là cytokine nhóm Th1 và cytokine nhóm Th2. Việc kích hoạt Th1 thường dẫn tới đáp ứng miễn dịch tế bào, phản ứng gây viêm để tấn công các vi sinh vật ký sinh nội bào (vi khuẩn, virus, động vật nguyên sinh), trong khi đó kích hoạt Th2 thường dẫn tới đáp ứng miễn dịch dịch thể, phản ứng kháng viêm và giúp tấn công các ký sinh trùng ngoại bào lớn như giun sán. Khi Th1 phản ứng thái quá sẽ dẫn tới phản ứng quá mẫn và tự miễn dịch làm hệ miễn dịch tự tấn công phá hủy các mô của cơ thể, còn Th2 khi quá mẫn thì dẫn tới phản ứng dị ứng. Để tránh việc một con đường kích hoạt quá mức thì sự cân bằng giữa Th1 và Th2 rất quan trọng.
Chúng ta cũng phải lưu ý một số điểm có liên quan tới cơ chế hoạt động của vaccine. Tá dược nhôm được cho là kích thích chủ yếu phản ứng miễn dịch theo con đường Th2. Nghiên cứu chỉ ra rằng với các trường hợp bệnh nhân COVID-19 nặng và tử vong thì tỷ lệ Th2 thường cao hơn Th1. Nhiều bằng chứng ủng hộ giả thuyết cho rằng Th2 là con đường không hiệu quả trong việc ngăn chặn virus tái bản và tỷ lệ Th2/Th1 cao có thể là một chỉ thị cho tình trạng bệnh nặng. Thí nghiệm trên mô hình động vật còn cho thấy việc kích hoạt con đường Th2 có thể dẫn tới hiện tượng lây nhiễm phụ thuộc kháng thể (ADE) khiến vật chủ sau khi tiêm vaccine lại biểu hiện bệnh nặng hơn khi nhiễm virus. Đây là thực tế đã xảy ra với vaccine SARS-CoV dạng virus bất hoạt và tiểu phần virus nên hiện nay luôn cần được theo dõi kỹ.
 |
| Quận 3 TP.HCM tiêm vaccine COVID-19 cho người già yếu, đi lại khó khăn. Ảnh: HCDC |
Các vaccine hiệu quả cao như Pfizer, Moderna, AstraZeneca, và ngay cả Novavax đã cho thấy đáp ứng theo con đường Th1 được kích hoạt sau khi tiêm vaccine. Các vaccine virus bất hoạt như Sinopharm, Sinovac đang sử dụng AH thì kích hoạt con đường Th2, trong khi đó một vaccine tiểu phần RBD của Trung Quốc là Zifivax cũng biểu hiện kháng nguyên từ tế bào CHO và dùng AH làm tá dược thì lại kích hoạt cả con đường Th1 và Th2.
Trong một số thử nghiệm vaccine như vaccine virus polio bất hoạt hay vaccine uốn ván đều có sử dụng tá dược nhôm thì con đường Th1 lại có đáp ứng tốt. Novavax đang dùng tá dược Matrix M có bản chất saponin, được cho là tạo đáp ứng miễn dịch mạnh hơn và đã được chứng minh là kích thích cả hai con đường Th1 và Th2.
Mặc dù khả năng cao Nanocovax kích thích đáp ứng miễn dịch theo con đường Th2 như các kết quả ban đầu của Nanogen gợi ý, nhưng chúng ta chưa thể chắc chắn Nanocovax kích thích đáp ứng miễn dịch theo con đường nào nếu chưa có bằng chứng trực tiếp. Cả hai cơ chế này đều xuất hiện ở các vaccine đang được dùng rộng rãi trên thế giới và các vaccine này đều có vai trò tích cực trong việc kiểm soát dịch ở các quốc gia, nên có lẽ thiết kế của Nanocovax cũng không phải là bất lợi. Tuy nhiên đây là câu hỏi cũng cần phải có bằng chứng làm sáng tỏ với Nanocovax, có thể là ở giai đoạn 3c hoặc pha 4.
*Cùng công nghệ sản xuất với Nanocovax trên thế giới đã có vaccine nào được cấp phép chưa, thưa ông?
TS Bùi Lê Minh: - Như tôi đã nhắc tới ở trên, có vài vaccine cùng loại công nghệ với Nanocovax nhưng chính xác thì không có vaccine nào được thiết kế giống hệt Nanocovax cả và chưa vaccine nào được cấp phép khẩn cấp của WHO. Ngoài Novavax thì đang có 3 vaccine khác sử dụng vaccine tiểu phần virus cũng đang liên hệ với WHO để xin cấp phép là Sanofi (Pháp), Viện Huyết thanh Ấn Độ và Clover Biopharmaceuticals (Trung Quốc).
*Xin cám ơn ông vì cuộc trao đổi!
Hội đồng Đạo đức: Vẫn chưa có dữ liệu để đánh giá trực tiếp hiệu lực bảo vệ của vaccine Nanocovax

Trước ngày 15/9, Nanogen phải nộp hồ sơ bổ sung của vaccine Nanocovax