Vì sao Hội đồng Đạo đức hoãn họp với Nanogen?
Mặc dù Hội đồng Đạo đức trong nghiên cứu Y Sinh học Quốc gia (HĐĐĐQG) đã lên kế hoạch họp với Nanogen vào hôm qua (ngày 15/8) để đánh giá kết quả thử nghiệm vaccine phòng COVID-19 NanoCovax giai đoạn 3a nhưng cuộc họp đã phải tạm hoãn.
Để tìm hiểu lý do vì sao cuộc họp quan trọng này không được tổ chức, sáng nay, ngày 16/8, PV VietTimes đã liên lạc với Bộ Y tế.
Trao đổi với PV, đại diện Bộ Y tế cho biết: “Lý do HĐĐĐQG hoãn họp với Nanogen để đánh giá kết quả thử nghiệm vaccine phòng COVID-19 NanoCovax giai đoạn 3a là vì đơn vị nghiên cứu (gồm: Học viện Quân Y, Viện Pasteur TP. HCM) và Công ty Nanogen hôm qua mới xong báo cáo và nộp trình lên HĐĐĐQG và Bộ Y tế để xem xét”.
Trước đó, trong cuộc họp khẩn cấp giữa HĐĐĐQG với Thứ trưởng Bộ Y tế Trần Văn Thuấn về việc xem xét dữ liệu thử nghiệm lâm sàng vaccine phòng COVID-19 Nanocovax của Nanogen diễn ra ngày 7/8, Thứ trưởng Bộ Y tế Trần Văn Thuấn đã yêu cầu các đơn vị tiêm thử nghiệm vaccine phòng COVID-19 gồm: Học viện Quân y, Viện Pasteur TP. HCM và đơn vị độc lập là Viện Vệ sinh dịch tễ Trung ương kết hợp với Công ty Cổ phần công nghệ sinh học dược Nanogen để nghiên cứu.
 |
Thứ trưởng Bộ Y tế Trần Văn Thuấn (Ảnh - Trần Minh) |
Sau khi Hội đồng đã cho phép nghiệm thu kết quả giai đoạn 1 và giữa kỳ giai đoạn 2, Thứ trưởng yêu cầu các đơn vị phải khẩn trương hoàn thiện, đồng thời, chuẩn bị ngay và gửi cho Hội đồng và Cục Khoa học Công nghệ và Đào tạo báo cáo pha 3a, gửi càng sớm càng tốt.
Kết hợp với kết quả của Tổ công tác, Thứ trưởng đề nghị Hội đồng tiếp tục họp vào ngày 15/8 để đánh giá kết quả giai đoạn 3a. Dựa trên kết quả đánh giá, Bộ Y tế đề nghị các chuyên gia trong Hội đồng khuyến nghị các biện pháp khẩn thiết, cần thiết, hợp lý.
Đặc biệt, tại cuộc họp Thứ trưởng Bộ Y tế Trần Văn Thuấn đã đề nghị HĐĐĐQG cân nhắc xem xét có nên tiến hành thêm 1 nghiên cứu bổ sung về việc tiêm mũi 3 vaccine phòng COVID-19 Nanocovax hay không, đồng thời, bổ sung các chủng mới của virus SARS-CoV-2 (chủng Delta) vào nghiên cứu ở thời điểm thích hợp.
Bộ Y tế chưa phê duyệt mở rộng địa bàn nghiên cứu giai đoạn 3 đối với vaccine phòng COVID-19 Nanocovax
Mới đây, Thứ trưởng Bộ Y tế Trần Văn Thuấn đã ký văn bản gửi UBND các tỉnh, thành phố trong cả nước về việc xem xét bổ sung địa bàn thử nghiệm vaccine phòng COVID-19 Nanocovax của Nanogen.
Theo Thứ trưởng Trần Văn Thuấn, thời gian qua Bộ Y tế nhận được đề nghị của một số tỉnh, thành phố về việc hỗ trợ tiêm thử nghiệm vaccine phòng COVID-19 NanoCovax do Công ty Cổ phần Công nghệ Sinh học Dược (Nanogen) nghiên cứu phát triển, hiện đang được thử nghiệm lâm sàng giai đoạn 3.
Về chủ trương, Bộ Y tế ủng hộ việc mở rộng địa bàn nghiên cứu thử nghiệm lâm sàng vaccine phòng COVID-19 Nanocovax. Tuy nhiên, việc mở rộng địa bàn nghiên cứu cần đảm bảo an toàn, khoa học, khả thi, tuân thủ đạo đức nghiên cứu, hồ sơ nghiên cứu phải được nhóm nghiên cứu xây dựng và đệ trình Bộ Y tế phê duyệt sau khi được HĐĐĐQG thẩm định và chấp thuận.
Bộ Y tế cấm sử dụng vaccine đang trong quá trình thử nghiệm cho mục đích sử dụng thí điểm hoặc mục đích thương mại.
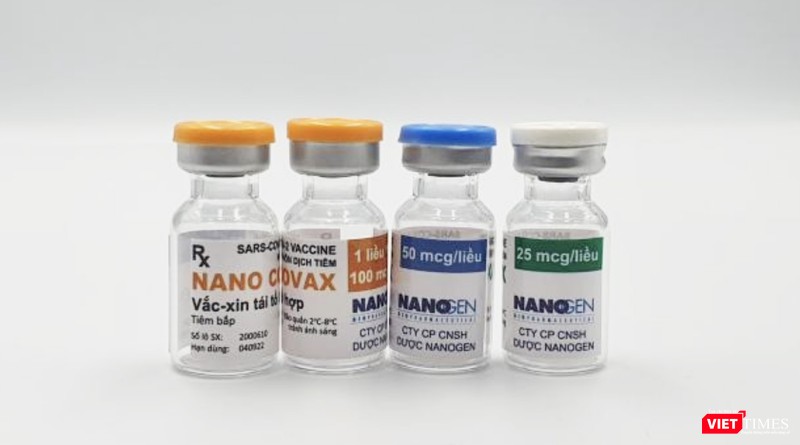 |
Vaccine phòng COVID-19 NanoCovax (Ảnh - MT) |
Trên cơ sở đề xuất của một số tỉnh, Bộ Y tế đã có công văn đề nghị các cơ quan chủ trì nghiên cứu (Học viện Quân y và Viện Pasteur TP. HCM) và Công ty Nanogen trả lời ý kiến của Bộ Y tế.
Sau khi nhận được thông tin từ Bộ Y tế, cơ quan chủ trì nghiên cứu cho biết: Họ sẽ tiếp tục triển khai theo đúng đề cương nghiên cứu đã được phê duyệt, không mở rộng thêm địa điểm triển khai thử nghiệm lâm sàng giai đoạn 3 vaccine Nanocovax để đảm bảo tiến độ báo cáo giữa kỳ và hoàn tất nghiên cứu so với kế hoạch được duyệt.
Còn Công ty Nanogen cho hay: Hiện nay, do tình hình dịch COVID-19 diễn biến phức tạp nên việc triển khai nghiên cứu trên diện rộng sẽ gặp nhiều khó khăn. Vì thế, Nanogen đề xuất không mở rộng địa bàn triển khai để tiếp tục tiến hành nghiên cứu giai đoạn 3 theo đề cương đã được Bộ Y tế phê duyệt.
Trên cơ sở trả lời của các cơ quan chủ trì nghiên cứu và nhà sản xuất, Bộ Y tế khẳng định: Bộ tạm thời chưa phê duyệt mở rộng địa bàn nghiên cứu thử nghiệm lâm sàng giai đoạn 3 đối với vaccine phòng COVID-19 Nanocovax trong giai đoạn hiện nay.
Hiện, Nanocovax là vaccine phòng COVID-19 đầu tiên của Việt Nam đã tiến hành thử nghiệm lâm sàng giai đoạn 3.
Trước khi thử nghiệm giai đoạn vaccine Nanocovax đã trải qua 2 giai đoạn thử nghiệm lâm sàng: Giai đoạn 1 bắt đầu từ ngày 18/12, giai đoạn 2 từ ngày 26/2 và giai đoạn 3 từ ngày 11/6.
Theo đề cương đã được phê duyệt, giai đoạn 3 tiêm thử nghiệm vaccine Nanocovax nhằm đánh giá yếu tố hiệu lực bảo vệ của vaccine đối với cộng đồng và được thực hiện tại nhiều trung tâm trong nước với 13.000 người; chỉ thực hiện tiêm nhóm liều duy nhất 25 mcg và nhóm tiêm giả dược đối chứng. Giai đoạn 3 chia làm 2 pha là pha 3a và pha 3b.

Hội đồng Đạo đức chưa nhận được bất kỳ báo cáo nào về hiệu lực bảo vệ của vaccine Nanocovax

BYT yêu cầu Nanogen báo cáo dữ liệu nghiên cứu vaccine Nanocovax pha 2, bước đầu pha 3 trước 15/8
NANOGEN đề nghị cấp phép sớm vaccine COVID-19 Nanocovax: Bộ Y tế nói gì?

Bộ Y tế sẽ nghiên cứu, xem xét việc cấp phép lưu hành khẩn cấp đối với vaccine Nanocovax